Modifikasi pada Gugus Amin dan Imin
Reaksi Mannich adalah sebuah reaksi organik yang mengandung alkilasi amino proton asam terletak di sebelah gugusfungsi karbonil dengan formaldehida dan amonia atau amina primer atau sekunder apapun. Produk akhirnya adalah senyawa β-amino-karbonil. Reaksi antara aldimina dan karbonil α-metilena juga dianggap sebagai reaksi Mannich karena imina ini merupakan bentuk antara amina dan aldehida.
Reaksi ini dinamakan atas kimiawan Carl Mannich.
Reaksi Mannich merupakan salah satu contoh adisi nukleofilik amina ke sebuah gugus karbonil yang diikuti oleh eliminasi anion hidroksil menjadi basa Schiff. Basa Schiff merupakan elektrofil yang bereaksi dalam dua langkah pada adisi nukleofilik kedua dengan karbanion yang dihasilkan dari senyawa yang mengandung proton asam. Oleh karena itu, reaksi Mannich mengandung sifat elektrofilik dan nukleofilik. Reaksi Mannich juga dianggap sebagai reaksi kondensasi.
Pada reaksi Mannich, amonia atau aminaprimer atau sekunder digunakan untuk aktivasi formaldehida. Amina tersier dan amina aril akan berhenti pada tahap basa Schiff karena ia kekurangan proton untuk membentuk zat antara imina. Senyawa α-CH-asam (Nukleofil) dapat berupa senyawa karbonil, senyawa nitril, senyawa asetilena, senyawa nitro alifatik, senyawa α- alkil-piridina, atau senyawa imina. Penggunaan heterolingkar seperti furan, pirola, dan tiofenajuga dimungkinkan, karena struktur mereka menyerupai bentuk enol dari senyawa karbonil.
Reaksi ini menghasilkan senyawa β-amino karbonil dan basa Mannich. Sebagai contoh lihat tropinon.
Reaksi Mannich memerlukan temperatur reaksi yang tinggi, waktu reaksi yang lama, dan pelarut protik. Pembentukkan produk sampingan yang tidak diinginkan merupakan fenomena yang umumnya terpantau.
Mekanisme Reaksi
Mekanisme reaksi Mannich dimulai dengan pembentukkan ion iminium dari amina dan formaldehida.
Karena reaksi berjalan dalam lingkungan asam, senyawa dengan gugus fungsi karbonil akan bertautomer menjadi bentuk enol. Setalah itu, ia akan menyerang ion iminium.
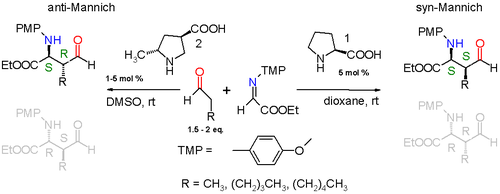
REAKSI MANNICH ASIMETRIK
Usaha memajukan reaksi Mannich asimetikjuga telah dilakukan. Ketika difungsionalisasikan dengan tepat, jembatan etilena yang baru terbentuk pada aduk Mannich akan mempunyai dua pusat prokiralyang akan menghasilkan dua pasangan diastereomerik enantiomer. Reaksi Mannich asimetrik yang pertama dilakukan adalah dengan menggunakan katalis (S)-prolina.[3]
Reaksi yang berlangsung adalah antara aldehida sederhana seperti propionaldehidadengan imina yang diturunkan dari etil glioksilat dan para-metoksi-anilina yang dikatalisasi oleh (S)-prolina dalam dioksanapada suhu kamar. Produk reaksi bersifat diastereoselektif dengan preferensi terhadap reaksi sin-Mannich 3:1 ketika substituen alkil pada aldehidanya adalah gugus metil atau 19:1 ketika gugus alkilnya adalah gugus yang lebih besar dari pentil. Dari dua kemungkinan aduk sin (S,S) atau (R,R), reaksi ini juga enantioselektif dengan preferensi terhadap aduk (S,S) dengan ekses enantiomerik yang lebih besar dari 99%. Skema 5 menjelaskan stereoselektivitas ini.
Prolina memasuki siklus katalitik dengan bereaksi dengan aldehida, membentuk enamina. Kedua reaktan (imina dan enamina) berposisi dalam reaksi Mannich dengan penyerangan muka Si imina oleh muka Si enamina-aldehida. Pelepasan terikan sterikmenyebabkan residu alkil R dari enamina dan gugus imina antiperiplanar. Enantioselektivitas juga dikontrol lebih jauh oleh ikatan hidrogen antara gugus asam karboksilat prolina dengan imina. Keadaan transisi untuk adisi ini adalah cincin beranggota sembila dengan konformasi kursidengan ikatan tunggal dan ganda parsial. Gugus prolina kemudian diubah kembali menjadi aldehida dan isomer S,S tunggal terbentuk.
Dengan modifikasi katalis prolina, adalah mungkin untuk mendapatkan aduk anti-Mannich [4]
Gugus metil tambahan yang melekat pada prolina memaksa pendekatan enamina spesifik dan keadaan transisinya adalah cincin beranggota sepuluh dengan adisi dalam mode anti. Diastereoselektivitasnya paling tidak anti:sin 95:5 tanpa memedulikan ukuran gugus alkil, dan enantiomer S,R difavoritkan dengan ekses enantiomerikpaling tidak 97%.
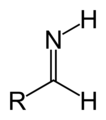
Imina atau imino adalah gugus fungsi atau senyawa kimia yang mengandung ikatan rangkap karbon–nitrogen. Atom nitrogen dapat melekat pada hidrogen (H) atau gugus organik (R). Jika gugus ini bukan atom hidrogen, maka senyawa tersebut kadang-kadang dapat dirujuk sebagai basa Schiff.[1] Atom larbon atom memiliki tambahan dua ikatan tunggal
Imina ( / ɪ ˈ m ː n / atau / ˈ ɪ m ɪ n / ) adalah gugus fungsi atau senyawa kimia yang mengandung ikatan rangkap karbon - nitrogen . Atom nitrogen dapat dilekatkan ke hidrogen (H) atau grup organik (R). Jika kelompok inibukan atom hidrogen, maka senyawa tersebut kadang-kadang dapat disebut sebagai pangkalan Schiff . [1] Atom karbon memiliki dua ikatan tunggal tambahan. [2] [3] [4] Istilah "imine" diciptakan pada tahun 1883 oleh kimiawan Jerman Albert Ladenburg . [5]
Nomenklatur dan klasifikasi
Biasanya imina mengacu pada senyawa dengan konektivitas R 2 C = NR, seperti yang dibahas di bawah ini. Dalam literatur yang lebih tua, imina mengacu pada analog aza dari epoksida. Dengan demikian, etilenimin adalah spesies cincin beranggota tiga C2H4 NH. [6]
Imina terkait dengan keton dan aldehid dengan penggantian oksigen dengan kelompok NR. Ketika R = H, senyawa tersebut adalah imina primer, ketika R adalah hidrokarbil , senyawa tersebut adalah imina sekunder. Imina menunjukkan reaktivitas yang beragam dan biasanya ditemui di seluruh kimia. [4] Ketika R 3 adalah OH, imine disebut oksime , dan ketika R 3 adalah NH 2 imina disebut hidrazon .
Imina primer di mana C melekat pada hidrokarbil dan H disebut aldimine primer ; imina sekunder dengan kelompok seperti ini disebut aldimine sekunder . [7] Imina primer di mana C melekat pada dua hidrokarbil disebut ketimine primer ; imina sekunder dengan kelompok seperti ini disebut ketimin sekunder . [8]
N-Sulfinyl imines adalah kelas khusus imina yang memiliki gugus sulfinil yang terikat pada atom nitrogen.
Sintesis imina
Imina biasanya disiapkan oleh kondensasi amina primer dan aldehida dan keton kurang umum:
Lebih banyak metode khusus
Beberapa metode lain ada untuk sintesis imina.
Reaksi yang paling penting dari imina adalah hidrolisis mereka ke senyawa amina dan karbonil yang sesuai. Jika tidak, gugus fungsi ini berpartisipasi dalam banyak reaksi lain, banyak yang analog dengan reaksi aldehida dan keton.
Agak seperti induk amina, imina sedikit bersifat basa dan dapat berefleksi secara reversibel untuk menghasilkan garam iminium. Turunan iminium sangat rentan terhadap reduksi ke amina menggunakan transfer hidrogenasi atau dengan aksi stoikiometrik natrium cyanoborohidrida .Karena imina yang berasal dari keton yang tidak simetris bersifat prokiral , reduksi mereka adalah metode yang berguna untuk sintesis amina kiral.
Sebagai ligan
Imina adalah ligan umum dalam kimia koordinasi . Kondensasi salicylaldehyde dan ethylenediaminememberi keluarga agen chelating yang mengandung imine seperti salen .
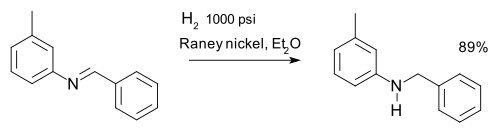
Pengurangan imina Imina dapat direduksi menjadi amina melalui hidrogenasi misalnya dalam sintesis m -tolylbenzylamine: [16] Zat pereduksi lain adalah lithium aluminium hidrida dan natrium borohidrida . [17]
Asymmetric imine reduction pertama dilaporkan pada tahun 1973 oleh Kagan menggunakan Ph (Me) C = NBn dan PhSiH 2 dalam hidrosililasi dengan ligan kiral Katalis DIOP dan rhodium (RhCl (CH 2 CH 2 ) 2 ) 2 . [18] Banyak sistem telah diselidiki. [19] [20]
Biasanya imina mengacu pada senyawa dengan konektivitas R 2 C = NR, seperti yang dibahas di bawah ini. Dalam literatur yang lebih tua, imina mengacu pada analog aza dari epoksida. Dengan demikian, etilenimin adalah spesies cincin beranggota tiga C2H4 NH. [6]
Imina terkait dengan keton dan aldehid dengan penggantian oksigen dengan kelompok NR. Ketika R = H, senyawa tersebut adalah imina primer, ketika R adalah hidrokarbil , senyawa tersebut adalah imina sekunder. Imina menunjukkan reaktivitas yang beragam dan biasanya ditemui di seluruh kimia. [4] Ketika R 3 adalah OH, imine disebut oksime , dan ketika R 3 adalah NH 2 imina disebut hidrazon .
Imina primer di mana C melekat pada hidrokarbil dan H disebut aldimine primer ; imina sekunder dengan kelompok seperti ini disebut aldimine sekunder . [7] Imina primer di mana C melekat pada dua hidrokarbil disebut ketimine primer ; imina sekunder dengan kelompok seperti ini disebut ketimin sekunder . [8]
- Aldimine primer
- Aziridine dan turunannya kadang-kadang disebut sebagai imina.
N-Sulfinyl imines adalah kelas khusus imina yang memiliki gugus sulfinil yang terikat pada atom nitrogen.
Sintesis imina
Imina biasanya disiapkan oleh kondensasi amina primer dan aldehida dan keton kurang umum:
- RNH 2 + R′C (O) R ′ ′ → RN = C (R ′) (R ′ ′) + H 2 O
Lebih banyak metode khusus
Beberapa metode lain ada untuk sintesis imina.
- Reaksi dari azida organik dengan logam carbenoid (diproduksi dari senyawa diazocarbonyl). [12]
- Kondensasi asam karbon dengan senyawa nitroso .
- Penataan ulang trityl N-haloamines dalam penataan ulang Stieglitz .
- Dehidrasi hemiaminal . [13]
- Dengan reaksi alkena dengan asam hidrazoat dalam reaksi Schmidt .
- Dengan reaksi asam nitril, asam klorida, dan aren dalam reaksi Hoesch .
- Sintesis multikomponen 3- tiazolina dalam reaksi Asinger .
- Ketimin primer dapat disintesis melalui reaksi Grignard dengan nitril . [14] [15]
Hexafluoroacetone imine adalah ketimine primer yang tidak biasa yang stabil.
- Imina berkurang dalam aminasi reduktif .
- Imina bereaksi dengan amina ke aminal , lihat misalnya sintesis cucurbituril .
- Sebuah imina bereaksi dengan diena dalam reaksi Aza Diels-Alder ke tetrahidropiridin.
- Imina dapat dioksidasi dengan asam meta-kloroperoksibenzoat (mCPBA) untuk memberikan oksaziridin
- Sebuah imina aromatik bereaksi dengan enol eter ke quinoline dalam reaksi Povarov .
- A tosylimine bereaksi dengan senyawa karbonil α, β-unsaturated ke amina alilik pada reaksi Aza-Baylis-Hillman .
- Imina adalah perantara dalam alkilasi amina dengan asam format dalam reaksi Eschweiler-Clarke .
- Penataan ulang dalam kimia karbohidrat yang melibatkan imina adalah penataan ulang Amadori .
- Reaksi transfer metilena dari imina oleh sulfonium ylide tidak stabil dapat memberikan sistem aziridine .
- Imina bereaksi, secara termal, dengan ketena dalam sikdisi siklik [2 + 2] untuk membentuk β-laktam dalam sintesis Staudinger .
- Sebuah imina dapat bereaksi dengan dialkilfosfit dalam reaksi Pudovik dan reaksiKabachnik-Fields
Agak seperti induk amina, imina sedikit bersifat basa dan dapat berefleksi secara reversibel untuk menghasilkan garam iminium. Turunan iminium sangat rentan terhadap reduksi ke amina menggunakan transfer hidrogenasi atau dengan aksi stoikiometrik natrium cyanoborohidrida .Karena imina yang berasal dari keton yang tidak simetris bersifat prokiral , reduksi mereka adalah metode yang berguna untuk sintesis amina kiral.
Sebagai ligan
Imina adalah ligan umum dalam kimia koordinasi . Kondensasi salicylaldehyde dan ethylenediaminememberi keluarga agen chelating yang mengandung imine seperti salen .
Pengurangan imina Imina dapat direduksi menjadi amina melalui hidrogenasi misalnya dalam sintesis m -tolylbenzylamine: [16] Zat pereduksi lain adalah lithium aluminium hidrida dan natrium borohidrida . [17]
Asymmetric imine reduction pertama dilaporkan pada tahun 1973 oleh Kagan menggunakan Ph (Me) C = NBn dan PhSiH 2 dalam hidrosililasi dengan ligan kiral Katalis DIOP dan rhodium (RhCl (CH 2 CH 2 ) 2 ) 2 . [18] Banyak sistem telah diselidiki. [19] [20]
Modifikasi kimia dari protein tiol dengan reduksi dan alkilasi adalah umum dalam persiapan sampel proteomik untuk analisis dengan spektrometri massa (MS). Modifikasi pada kelompok fungsional lainnya kurang mendapat perhatian pada proteomik berbasis-MS. Modifikasi amina (Lys, N-termini) oleh dimetilasi reduktif atau dengan asilasi (misalnya pelabelan iTRAQ) baru-baru ini mendapatkan popularitas dalam pendekatan berbasis peptida (MS dari bawah). Modifikasi pada kelompok asam (Asp, Glu, C-termini) telah dieksplorasi sangat minim. Di sini, kami menggambarkan strategi pelabelan berurutan yang memungkinkan modifikasi lengkap tiol, amina, dan asam pada peptida atau protein utuh kecil. Metode ini termasuk (1 ) reduksi dan alkilasi tiol, ( 2 ) reduksi dimetilasi amina, dan ( 3 ) penengahan asam dengan beberapa amina. Skema modifikasi kimia ini menawarkan beberapa pilihan baik untuk penggabungan isotop stabil untuk kuantifikasi relatif dan untuk meningkatkan peptida atau protein sebagai analit MS.
Modifikasi Grup Amino
Modifikasi gugus amino melibatkan penambahan gugus fungsi pada ujung N dari asam amino .
Protein setelah terjemahannya mengalami modifikasi kimia yang disebut Post Translational Modification . Modifikasi ini dapat mengubah fungsi protein ketika melekat pada kelompok fungsional biokimia seperti asetat dengan mengubah sifat kimia dari asam amino atau dengan perubahan struktural seperti lipat, distribusi konformasi, stabilitas, aktivitas dll.
Jenis Modifikasi Grup Amino
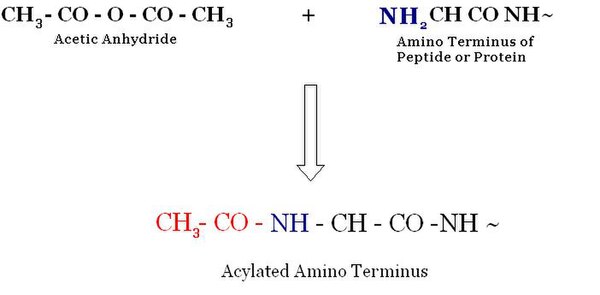
Asetilasi
Asetalisasi adalah proses asilasi (pengantar gugus asil ke senyawa organik) yang melibatkan substitusi gugus asam asetat organik untuk atom hidrogen aktif pada N-terminus.
Modifikasi paling luas pada eukariota adalah Asetilasi dari kelompok protein α-amina N-terminal.Sekitar 50% protein ragi dan sekitar 90% protein pada manusia dimodifikasi oleh mekanisme ini.Pola modifikasi dilestarikan sepanjang evolusi. Meskipun itu adalah modifikasi umum, tidak banyak informasi yang tersedia untuk tentang fungsi biologis dari asetilasi N-α-terminal. N-α-acetyltransferase (NATs) adalah enzim yang bertanggung jawab untuk Asetilasi. NAT milik keluarga GNAT, yang terletak di bawah superfamili acetyltransferases . [1] Asetilasi dan deasetilasi terjadi pada residu lisin di ekor N-terminal di asetilasi dan deasetilasi histone . Reaksi-reaksi ini terjadi di hadapan enzim histone acetyltransferase (HAT) atau histone deacetylase (HDAC).
Formasi Pyroglutamate Pyroglutamate terbentuk melalui siklisasi (pembentukan cincin dalam senyawa kimia) glutamin .Ini biasanya diamati pada antibodi yang mengandung residu glutamat atau glutamin pada N-termini. Gugus amino dan glutamat atau glutamin mengembun membentuk cincin lima anggota yang disebut Pyroglutamate. Residu ini membuat protein lebih tahan terhadap aminopeptidasedan memiliki banyak peran fungsional. [2]
Ia mempertahankan integritas struktural pada N-terminal α-helix dan menyediakan lingkungan yang tepat untuk ionisasi residu Histidin untuk katalisis dan sitotoksisitas terhadap sel HeLa .
Myristoylation
N-myristoylation juga merupakan proses asilasi yang ditemukan khusus untuk gliserin asam amino N-terminal dalam protein di mana kelompok myristoy (berasal dari asam miristat) secara kovalen dilampirkan melalui ikatan amida dengan gugus alpha-amino N-terminal Glycine. Myristoylation memainkan peran penting dalam pensinyalan seluler sekunder, dalam infektivitas retrovirus dan onkogenesis pada Eukariota. Ini juga mempengaruhi fungsi fisiologis protein pengikat kalsium. [3]Enzim cytosolic N-myristoyltransferase (NMT) mengkatalisis Myristoylation.
Methylation
Metilasi protein adalah bentuk modifikasi pasca-translasi yang paling umum yang diamati. Mirip dengan modifikasi pasca-translasi lainnya, metilasi protein terlibat dalam mengatur interaksi protein-protein yang menghasilkan sejumlah besar efek selama peristiwa seluler utama, termasuk pengaturan transkripsi [4] [5] [6] respon stres, penuaan dan perbaikan protein [ 7] Aktivasi sel-T [8] , transportasi nuklir [9] , diferensiasi neuronal [10] , [11] fungsi saluran ion, dan pensinyalan sitokin.Protein dianggap termetilasi ketika kelompok metil ditambahkan pada satu atau lebih rantai samping nukleofilik. Metilasi pada rantai samping nitrogens dianggap sangat tidak dapat diubah sementara metilasi dari gugus karboksil berpotensi reversibel. Residu protein yang termetilasi pada nitrogen termasuk e-amin dari lisin, cincin imidazol histidin, bagian guanidino arginin, dan rantai samping amida nitrit glutamin dan asparagin. Metilasi dalam protein meniadakan muatan negatif di atasnya dan meningkatkan hidrofobisitas protein. Metilasi pada rantai samping karboksilat menutupi muatan negatif dan menambah hidrofobik. N-Metilasi lisin tidak mengubah muatan kationik tetapi meningkatkan hidrofobik.Khususnya, dimetilasi dan trimetilasi rantai samping lisin dalam protein meningkatkan baik hidrofobik dan massa sterik dan dapat mempengaruhi interaksi protein-protein jika mereka berada dalam permukaan yang berinteraksi.
Karbamilasi
Karbamilasi terjadi ketika asam isocyanic (HCNO) bereaksi dengan residu amino terminus, seperti lisin, dari protein. Ini adalah salah satu modifikasi protein artifactual umum yang diakui untuk fokus Isoeletric . Faktor risikonya adalah urea (chaotrope) yang ada dalam larutan dan berada dalam kesetimbangan dengan amonium sianat . Asam isosianat adalah bentuk sianat yang bereaksi dengan gugus amino protein. Untuk karbamilasi terjadi gugus asam amino protein seperti lisin, rantai samping arginin harus terdeprotonasi yang biasanya terjadi pada pH basa.Karbamilasi terjadi ketika protein dibiarkan pada suhu kamar dalam larutan urea dan di mana asam isosianat dapat dengan bebas bereaksi dengan protein.
Karbamilasi oleh asam isosianat negatif untuk langkah selanjutnya dari karakterisasi protein karena asam isosianat bereaksi dengan ujung amino protein memblokir peptida atau protein ke sekuens N-terminal. Asam isosianat menyerang rantai samping residu lisin dan arginin yang membuat protein tidak cocok untuk banyak pencernaan enzim. Bahkan jika karbamilasi tidak mencegah digest enzimatik, seringkali akan membingungkan hasil dari eksperimen spektroskopi massa dengan peptida yang memiliki waktu retensi dan massa yang tidak terduga. Karbamilasi protein in vivo diamati di beberapa negara berpenyakit. [12]
Formilasi
Formilasi adalah salah satu modifikasi posttranslational protein, di mana protein dimodifikasi oleh lampiran kelompok formil. Mekanisme yang paling umum dipelajari adalah N6-formilasi lisin yang terkait dengan histone dan protein nuklir lainnya. Modifikasi translasi post histone dan protein kromatin lainnya memainkan peran dalam fisiologi ekspresi gen . "Residu N6-formil-lisin muncul untuk mewakili modifikasi sekunder histone endogen, yang mengandung kesamaan kimia dengan lisin N6-asetilasi yang diakui sebagai penentu penting ekspresi gen pada sel mamalia." Dari penelitian itu disimpulkan bahwa modifikasi N6-formil dari lisin mengganggu fungsi sinyal asetilasi dan metilasi, yang memainkan peran dalam fisiologi stres oksidatif dan nitrosatif. [13]
Protein setelah terjemahannya mengalami modifikasi kimia yang disebut Post Translational Modification . Modifikasi ini dapat mengubah fungsi protein ketika melekat pada kelompok fungsional biokimia seperti asetat dengan mengubah sifat kimia dari asam amino atau dengan perubahan struktural seperti lipat, distribusi konformasi, stabilitas, aktivitas dll.
Jenis Modifikasi Grup Amino
Asetilasi
Asetalisasi adalah proses asilasi (pengantar gugus asil ke senyawa organik) yang melibatkan substitusi gugus asam asetat organik untuk atom hidrogen aktif pada N-terminus.
Modifikasi paling luas pada eukariota adalah Asetilasi dari kelompok protein α-amina N-terminal.Sekitar 50% protein ragi dan sekitar 90% protein pada manusia dimodifikasi oleh mekanisme ini.Pola modifikasi dilestarikan sepanjang evolusi. Meskipun itu adalah modifikasi umum, tidak banyak informasi yang tersedia untuk tentang fungsi biologis dari asetilasi N-α-terminal. N-α-acetyltransferase (NATs) adalah enzim yang bertanggung jawab untuk Asetilasi. NAT milik keluarga GNAT, yang terletak di bawah superfamili acetyltransferases . [1] Asetilasi dan deasetilasi terjadi pada residu lisin di ekor N-terminal di asetilasi dan deasetilasi histone . Reaksi-reaksi ini terjadi di hadapan enzim histone acetyltransferase (HAT) atau histone deacetylase (HDAC).
Formasi Pyroglutamate Pyroglutamate terbentuk melalui siklisasi (pembentukan cincin dalam senyawa kimia) glutamin .Ini biasanya diamati pada antibodi yang mengandung residu glutamat atau glutamin pada N-termini. Gugus amino dan glutamat atau glutamin mengembun membentuk cincin lima anggota yang disebut Pyroglutamate. Residu ini membuat protein lebih tahan terhadap aminopeptidasedan memiliki banyak peran fungsional. [2]
Ia mempertahankan integritas struktural pada N-terminal α-helix dan menyediakan lingkungan yang tepat untuk ionisasi residu Histidin untuk katalisis dan sitotoksisitas terhadap sel HeLa .
Myristoylation
N-myristoylation juga merupakan proses asilasi yang ditemukan khusus untuk gliserin asam amino N-terminal dalam protein di mana kelompok myristoy (berasal dari asam miristat) secara kovalen dilampirkan melalui ikatan amida dengan gugus alpha-amino N-terminal Glycine. Myristoylation memainkan peran penting dalam pensinyalan seluler sekunder, dalam infektivitas retrovirus dan onkogenesis pada Eukariota. Ini juga mempengaruhi fungsi fisiologis protein pengikat kalsium. [3]Enzim cytosolic N-myristoyltransferase (NMT) mengkatalisis Myristoylation.
Methylation
Metilasi protein adalah bentuk modifikasi pasca-translasi yang paling umum yang diamati. Mirip dengan modifikasi pasca-translasi lainnya, metilasi protein terlibat dalam mengatur interaksi protein-protein yang menghasilkan sejumlah besar efek selama peristiwa seluler utama, termasuk pengaturan transkripsi [4] [5] [6] respon stres, penuaan dan perbaikan protein [ 7] Aktivasi sel-T [8] , transportasi nuklir [9] , diferensiasi neuronal [10] , [11] fungsi saluran ion, dan pensinyalan sitokin.Protein dianggap termetilasi ketika kelompok metil ditambahkan pada satu atau lebih rantai samping nukleofilik. Metilasi pada rantai samping nitrogens dianggap sangat tidak dapat diubah sementara metilasi dari gugus karboksil berpotensi reversibel. Residu protein yang termetilasi pada nitrogen termasuk e-amin dari lisin, cincin imidazol histidin, bagian guanidino arginin, dan rantai samping amida nitrit glutamin dan asparagin. Metilasi dalam protein meniadakan muatan negatif di atasnya dan meningkatkan hidrofobisitas protein. Metilasi pada rantai samping karboksilat menutupi muatan negatif dan menambah hidrofobik. N-Metilasi lisin tidak mengubah muatan kationik tetapi meningkatkan hidrofobik.Khususnya, dimetilasi dan trimetilasi rantai samping lisin dalam protein meningkatkan baik hidrofobik dan massa sterik dan dapat mempengaruhi interaksi protein-protein jika mereka berada dalam permukaan yang berinteraksi.
Karbamilasi
Karbamilasi terjadi ketika asam isocyanic (HCNO) bereaksi dengan residu amino terminus, seperti lisin, dari protein. Ini adalah salah satu modifikasi protein artifactual umum yang diakui untuk fokus Isoeletric . Faktor risikonya adalah urea (chaotrope) yang ada dalam larutan dan berada dalam kesetimbangan dengan amonium sianat . Asam isosianat adalah bentuk sianat yang bereaksi dengan gugus amino protein. Untuk karbamilasi terjadi gugus asam amino protein seperti lisin, rantai samping arginin harus terdeprotonasi yang biasanya terjadi pada pH basa.Karbamilasi terjadi ketika protein dibiarkan pada suhu kamar dalam larutan urea dan di mana asam isosianat dapat dengan bebas bereaksi dengan protein.
Karbamilasi oleh asam isosianat negatif untuk langkah selanjutnya dari karakterisasi protein karena asam isosianat bereaksi dengan ujung amino protein memblokir peptida atau protein ke sekuens N-terminal. Asam isosianat menyerang rantai samping residu lisin dan arginin yang membuat protein tidak cocok untuk banyak pencernaan enzim. Bahkan jika karbamilasi tidak mencegah digest enzimatik, seringkali akan membingungkan hasil dari eksperimen spektroskopi massa dengan peptida yang memiliki waktu retensi dan massa yang tidak terduga. Karbamilasi protein in vivo diamati di beberapa negara berpenyakit. [12]
Formilasi
Formilasi adalah salah satu modifikasi posttranslational protein, di mana protein dimodifikasi oleh lampiran kelompok formil. Mekanisme yang paling umum dipelajari adalah N6-formilasi lisin yang terkait dengan histone dan protein nuklir lainnya. Modifikasi translasi post histone dan protein kromatin lainnya memainkan peran dalam fisiologi ekspresi gen . "Residu N6-formil-lisin muncul untuk mewakili modifikasi sekunder histone endogen, yang mengandung kesamaan kimia dengan lisin N6-asetilasi yang diakui sebagai penentu penting ekspresi gen pada sel mamalia." Dari penelitian itu disimpulkan bahwa modifikasi N6-formil dari lisin mengganggu fungsi sinyal asetilasi dan metilasi, yang memainkan peran dalam fisiologi stres oksidatif dan nitrosatif. [13]
Amina adalah senyawa organik dan gugus fungsi yang mengandung nitrogen basa dengan pasangan elektron bebas. Perlindungan nitrogen terus menarik banyak perhatian dalam bidang kimia, seperti peptida, nukleosida, polimer dan sintesis ligan. Tetapi, dalam beberapa tahun terakhir, sejumlah gugus pelindung nitrogen telah digunakan sebagai pembantu kiral. Dengan demikian, desain baru, lebih ringan dan metodenya lebih efektif untuk perlindungan nitrogen masih aktif dalam topik sintesis kimia.
Gugus Pelindung imida dan amida: Kelompok ftalimida telah berhasil digunakan untuk melindungi gugus amino. Pembelahan dari N-alkilftalimida (1,81) mudah dilakukan dengan hidrazin, dalam larutan panas atau dalam dingin untuk waktu yang lama untuk memberikan (1,82) dan amina. Basa katalis hidrolisis N-alkilftalimida (1.81) juga memberikan yang sesuai amina.
Modifikasi Kitosan
Adanya gugus amina (NH2) dan dan hidroksil (OH) dari kitosan menyebabkan kitosan mudah dimodifikasi secara kimia.
Gugus aktif pada kitosan
Bila dibutuhkan perubahan gugus fungsional untuk menghalangi gangguan dalam beberapa rangkaian reaksi sintesis, salah satu caranya adalah dengan menggunakan gugus pelindung. Gugus pelindung merupakan suatu turunan yang dapat dibuat dan kemudian dihilangkan. Tiga syarat-syarat yang perlu diperhatikan dalam memilih gugus pelindung adalah sebagai berikut :
1. Gugus pelindung yang digunakan harus lebih reaktif
2. Gugus pelindung yang dipakai harus dengan mudah bereaksi dengan molekul target.
3. Kondisi reaksi dalam memasukkan gugus pelindung harus stabil.
4. Dapat dimasukkan pada kondisi reaksi lunak
5. Gugus pelindung harus dapat dengan mudah dihilangkan tanpa menggangu reaksi akhir.
Reaksi penggunaan gugus pelindung pada kitosan dikarenakan kitosan memiliki 2 gugus fungsi yang kereaktifan berbeda. Gugus amino dari kitosan lebih reaktif dari pada gugus hidroksilnya, sehingga untuk menghasilkan O-asilasi kitosan, perlu dilakukan proteksi atau perlindungan terhadap gugus amino. Basa shiff dapat digunakan sebagai gugus pelindung pada reaksi O-asilasi.
Gugus amino kitosan lebih reaktif daripada gugus hidroksilnya, sehingga untuk menghasilkan O-asilasi kitosan perlu dilakukan proteksi atau perlindungan terhadap gugus amin selama proses asilasi untuk menghasilkan O-Asil kitosan. Metode proteksi yang dilakukan antara lain melalui pembuatan basa Schiff disusul O-Asetilasi menggunakan larutan asetat anhidrin-piridin untuk mencegah hidrolisis asam dari basa Schiff. Reaksi antara kitosan dengan anhidrida asetat menghasilkan senyawa ester yang merupakan kitosan asetat. Dalam hal ini kitosan terlebih dahulu direaksikan dengan asetaldehida membentuk aldimin untuk melindungi gugus amina. Kitosan laurat diperoleh dari reaksi transesterifikasi antara metil laurat dengan kitosan asetat. Selanjutnya dilakukan deproteksi dengan menambahkan natrium bikarbonat untuk memperoleh kitosan laurat.
Basa Schiff dapat digunakan sebagai gugus pelindung pada gugus amin (NH2), dilakukan dengan melarutkan kitosan terasetilasi dalam asam formiat 90% yang mengandung asetat anhidrida dengan asumsi protonasi akan mencegah terjadinya N-asilasi. Selanjutnya direaksikan dengan asilklorida dalam karbon triklorida dan piridin kering.
Contoh lain gugus pelindung untuk NH2 yaitu:
Gugus amino, N dari kitosan lebih reaktif dari pada gugus hidroksilnya, sehingga untuk menghasilkan O-asilasi kitosan perlu dilakukan proteksi atau perlindungan terhadap gugus amino. Reaksi O-asilasi dapat dilakukan melalui reaksi esterifikasi menggunakan katalis asam sulfat (2 M) ditambahkan kepada suspensi campuran kitosan dan asam alkanoat pada suhu kamar. Campuran dipanaskan pada suhu 80oC selama 4 jam disertai pengadukan. Asam sulfat yang ditambahkan akan membentuk ion hidrogen sulfit sebagai konter ion dari NH3+, selanjutnya berfungsi untuk memproteksi (sebagai gugus pelindung) N-kitosan. Kemudian pada suhu kamar, tambahkan natrium hidrokarbonat sampai pH 7 (netral).
Permasalahan :
1. Reaksi Mannich memerlukan temperatur reaksi yang tinggi, waktu reaksi yang lama, dan pelarut protik. Pembentukkan produk sampingan yang tidak diinginkan merupakan fenomena yang umumnya terpantau. Mengapa dalam reaksi mannich harus melalui temperatur yang tinggi, kemudian bagaimana cara agar dapat mengurangi dari hasil produk sampingan yang tidak diinginkan?
2. Protein setelah terjemahannya mengalami modifikasi kimia yang disebut Post Translational Modification . Modifikasi ini dapat mengubah fungsi protein ketika melekat pada kelompok fungsional biokimia seperti asetat dengan mengubah sifat kimia dari asam amino atau dengan perubahan struktural seperti lipat, distribusi konformasi, stabilitas, aktivitas dll. Bagaimana fungsional dari protein?
3. Gugus amino kitosan lebih reaktif daripada gugus hidroksilnya, sehingga untuk menghasilkan O-asilasi kitosan perlu dilakukan proteksi atau perlindungan terhadap gugus amin selama proses asilasi untuk menghasilkan O-Asil kitosan. Bagaimana metode yang digunakan dalam hal tersebut?












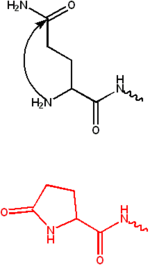



Saya akan menjawab permasalaahn ke 2 Modifikasi gugus amino melibatkan penambahan gugus fungsi pada ujung N dari asam amino .
BalasHapusProtein setelah terjemahannya mengalami modifikasi kimia yang disebut Post Translational Modification . Modifikasi ini dapat mengubah fungsi protein ketika melekat pada kelompok fungsional biokimia seperti asetat dengan mengubah sifat kimia dari asam amino atau dengan perubahan struktural seperti lipat, distribusi konformasi, stabilitas, aktivitas dll.
Nomor 3 Reaksi penggunaan gugus pelindung pada kitosan dikarenakan kitosan memiliki 2 gugus fungsi yang kereaktifan berbeda. Gugus amino dari kitosan lebih reaktif dari pada gugus hidroksilnya, sehingga untuk menghasilkan O-asilasi kitosan, perlu dilakukan proteksi atau perlindungan terhadap gugus amino. Basa shiff dapat digunakan sebagai gugus pelindung pada reaksi O-asilasi.
BalasHapusGugus amino kitosan lebih reaktif daripada gugus hidroksilnya, sehingga untuk menghasilkan O-asilasi kitosan perlu dilakukan proteksi atau perlindungan terhadap gugus amin selama proses asilasi untuk menghasilkan O-Asil kitosan. Metode proteksi yang dilakukan antara lain melalui pembuatan basa Schiff disusul O-Asetilasi menggunakan larutan asetat anhidrin-piridin untuk mencegah hidrolisis asam dari basa Schiff. Reaksi antara kitosan dengan anhidrida asetat menghasilkan senyawa ester yang merupakan kitosan asetat. Dalam hal ini kitosan terlebih dahulu direaksikan dengan asetaldehida membentuk aldimin untuk melindungi gugus amina. Kitosan laurat diperoleh dari reaksi transesterifikasi antara metil laurat dengan kitosan asetat. Selanjutnya dilakukan deproteksi dengan menambahkan natrium bikarbonat untuk memperoleh kitosan laurat.
Saya akan menjawab no 3.
BalasHapusMetode proteksi yang dilakukan antara lain melalui pembuatan basa Schiff disusul O-Asetilasi menggunakan larutan asetat anhidrin-piridin untuk mencegah hidrolisis asam dari basa Schiff. Reaksi antara kitosan dengan anhidrida asetat menghasilkan senyawa ester yang merupakan kitosan asetat. Dalam hal ini kitosan terlebih dahulu direaksikan dengan asetaldehida membentuk aldimin untuk melindungi gugus amina. Kitosan laurat diperoleh dari reaksi transesterifikasi antara metil laurat dengan kitosan asetat. Selanjutnya dilakukan deproteksi dengan menambahkan natrium bikarbonat untuk memperoleh kitosan laurat.
Basa Schiff dapat digunakan sebagai gugus pelindung pada gugus amin (NH2), dilakukan dengan melarutkan kitosan terasetilasi dalam asam formiat 90% yang mengandung asetat anhidrida dengan asumsi protonasi akan mencegah terjadinya N-asilasi. Selanjutnya direaksikan dengan asilklorida dalam karbon triklorida dan piridin kering.
Saya akan mencoba menjawab permasalahan yang ke 2 Penerapan modifikasi fungsional dari protein
BalasHapusPenerapan metode kimia dan enzimatis untuk memodifikasi sifat kimia dan fungsional dari protein makanan memiliki sejarah panjang dari penggunaan, modifikasi protein secara kimiawi dan enzimatis sering dilakukan untuk memperbaiki sifat-sifat fungsionalnya, yaitu kelarutan, kapasitas penyerapan air, sifat pengemulsian, dan pembuihan. Modifikasi secara kimiawi dapat dilakukan dengan cepat dan biaya rendah, namun berperah terhadap nilai gizinya. Sedangkan modifikasi secara enzimatis membutuhkan jenis enzim dan kondisi proses yang spesifik, meskipun pengaruhnya terhadap nilai gizi kecil. seperti digambarkan oleh modifikasi enzimatik protein susu untuk menghasilkan yogurt dan keju
Saya akan menjawab permasalahan ketiga
BalasHapusBasa Schiff dapat digunakan sebagai gugus pelindung pada gugus amin (NH2), dilakukan dengan melarutkan kitosan terasetilasi dalam asam formiat 90% yang mengandung asetat anhidrida dengan asumsi protonasi akan mencegah terjadinya N-asilasi. Selanjutnya direaksikan dengan asilklorida dalam karbon triklorida dan piridin kering.
Saya akan menjawab permasalahan ketiga
BalasHapusBasa Schiff dapat digunakan sebagai gugus pelindung pada gugus amin (NH2), dilakukan dengan melarutkan kitosan terasetilasi dalam asam formiat 90% yang mengandung asetat anhidrida dengan asumsi protonasi akan mencegah terjadinya N-asilasi. Selanjutnya direaksikan dengan asilklorida dalam karbon triklorida dan piridin kering.
Saya akan menjawab permasalaahn ke 2 Modifikasi gugus amino melibatkan penambahan gugus fungsi pada ujung N dari asam amino .
BalasHapusProtein setelah terjemahannya mengalami modifikasi kimia yang disebut Post Translational Modification . Modifikasi ini dapat mengubah fungsi protein ketika melekat pada kelompok fungsional biokimia seperti asetat dengan mengubah sifat kimia dari asam amino atau dengan perubahan struktural seperti lipat, distribusi konformasi, stabilitas, aktivitas dll.
Nomor 3 Reaksi penggunaan gugus pelindung pada kitosan dikarenakan kitosan memiliki 2 gugus fungsi yang kereaktifan berbeda. Gugus amino dari kitosan lebih reaktif dari pada gugus hidroksilnya, sehingga untuk menghasilkan O-asilasi kitosan, perlu dilakukan proteksi atau perlindungan terhadap gugus amino. Basa shiff dapat digunakan sebagai gugus pelindung pada reaksi O-asilasi.
BalasHapusGugus amino kitosan lebih reaktif daripada gugus hidroksilnya, sehingga untuk menghasilkan O-asilasi kitosan perlu dilakukan proteksi atau perlindungan terhadap gugus amin selama proses asilasi untuk menghasilkan O-Asil kitosan.
Saya jawab no 3dahulu direaksikan dengan asetaldehida membentuk aldimin untuk melindungi gugus amina. Kitosan laurat diperoleh dari reaksi transesterifikasi antara metil laurat dengan kitosan asetat. Selanjutnya dilakukan deproteksi dengan menambahkan natrium bikarbonat untuk memperoleh kitosan laurat.
BalasHapusBasa Schiff dapat digunakan sebagai gugus pelindung pada gugus amin (NH2), dilakukan dengan melarutkan kitosan terasetilasi dalam asam formiat 90% yang mengandung asetat anhidrida dengan asumsi protonasi akan mencegah terjadinya N-asilasi. Selanjutnya direaksikan dengan asilklorida dalam karbon triklorida dan piridin kering.
Saya akan menjawab nomor 3. Gugus amino dari kitosan lebih reaktif dari pada gugus hidroksilnya, sehingga untuk menghasilkan O-asilasi kitosan, perlu dilakukan proteksi atau perlindungan terhadap gugus amino. Basa shiff dapat digunakan sebagai gugus pelindung pada reaksi O-asilasi.
BalasHapuspermasalahan nomor 3
BalasHapusGugus amino kitosan lebih reaktif daripada gugus hidroksilnya, sehingga untuk menghasilkan O-asilasi kitosan perlu dilakukan proteksi atau perlindungan terhadap gugus amin selama proses asilasi untuk menghasilkan O-Asil kitosan. Metode proteksi yang dilakukan antara lain melalui pembuatan basa Schiff disusul O-Asetilasi menggunakan larutan asetat anhidrin-piridin untuk mencegah hidrolisis asam dari basa Schiff. Reaksi antara kitosan dengan anhidrida asetat menghasilkan senyawa ester yang merupakan kitosan asetat. Dalam hal ini kitosan terlebih dahulu direaksikan dengan asetaldehida membentuk aldimin untuk melindungi gugus amina. Kitosan laurat diperoleh dari reaksi transesterifikasi antara metil laurat dengan kitosan asetat. Selanjutnya dilakukan deproteksi dengan menambahkan natrium bikarbonat untuk memperoleh kitosan laurat.